Brain故事
浙江大学医学院神经科学研究所的包爱民教授与荷兰皇家科学院神经科学研究所Dick Swaab教授的合作研究于人脑样本揭示了若干调节突触活性和可塑性关键分子可能参与了阿尔兹海默病(AD)病程中脑内胆碱能神经元活性早期升高而晚期降低现象的发生机制。该研究于2016年3月份在国际著名的神经科学杂志Brain上发表。
AD是老年期痴呆症的最常见类型,起病隐袭,病程呈慢性进展性,表现为渐进性记忆与认知功能障碍、人格改变等神经精神症状,严重影响患者的社交、职业与生活能力,给家庭和社会带来巨大经济负担和严重精神压力。长期以来研究者根据从独立的AD患者脑组织样本中所观察到的神经病理学标记物去推测AD的发病机制,设计针对这些病理学改变为靶点的药物,未能取得显著疗效。在过去的几十年里,随着世界各地人脑组织库的建立,基于针对越来越大样本量的、系统的AD脑组织的研究,科学家们惊奇地发现,在AD漫长的病程中,脑内发生过令人惊讶的改变:在AD早期,大脑似乎意识到疾病的发生,在包括前额叶等脑区几百余调节突触活性与可塑性的基因激烈上调,这个阶段的患者无临床痴呆症状或仅仅表现为轻微认知功能损害;这几百种基因在AD晚期显著下调,伴随临床痴呆症状。AD脑内这种部分脑区活性先升后降的变化模式激励研究者探寻AD早期脑功能激活机制,以便为晚期AD的治疗提供合理的策略和药物靶点。
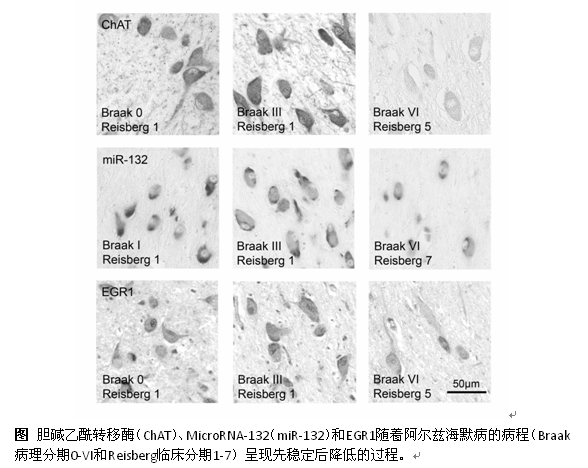
包爱民教授与Dick Swaab教授合作的研究针对脑内神经递质乙酰胆碱的主要产生脑区Meynert基底核(NBM),选取既调节突触活性与可塑性又参与胆碱能活性调节及AD病理学标记发生的微小RNA -132(miR-132)和早期生长因子-1 (EGR1)为目标候选分子,即调节AD进程中NBM活性先升后降模式的分子。他们从荷兰人脑库申请到了囊括了整个AD病程,包括病理学分期Braak 0-VI期,同时覆盖临床Reisberg分期1-7期的人脑NBM标本,研究了AD进程中NBM内miR-132和Egr-1的表达变化及其与经典AD病理标记即过度磷酸化的tau与细胞内外的β-淀粉样蛋白,以及与胆碱合成酶,即胆碱乙酰转移酶(ChAT)的关联。研究发现miR-132和EGR1在AD早期保持稳定,而在AD晚期下降,与ChAT表达呈显著正相关而与AD病理学改变显负相关。该研究于人脑组织提供了这两个分子参与AD病程中胆碱能活性改变的科学依据,为之后的分子作用机制研究奠定基础。
这篇论文的第一作者是博士生朱琼彬,该研究得到了国家自然基金委和浙江大学“985工程”创新人才培养项目专项资金的资助。