高志华教授与段树民院士团队在《Glia》发表论文,揭示mTOR信号通路在调节小胶质细胞代谢重编程中的作用
2020年5月21日,《胶质细胞》发表了浙江大学脑科学与脑医学学院高志华教授与段树民院士团队关于小胶质细胞代谢特性的研究,题为“mTOR-mediated metabolic reprogramming shapes distinct microglia functions in response to lipopolysaccharide and ATP”。
小胶质细胞是中枢神经系统 (Central nervous system, CNS)固有的免疫细胞。小胶质细胞在生理状态下,可以不断地通过突起观测周围微环境。当损伤或疾病发生后,小胶质细胞迅速响应,细胞突起向受损部位迁移,清除有害物质,并通过释放细胞因子引起免疫反应。但是关于小胶质细胞的代谢模式是如何维持细胞的动态监视以及快速响应脑环境变化的研究甚少。
高志华教授与段树民院士团队首先通过转录组分析比较LPS激活的M1促炎型小胶质细胞以及IL-4激活的M2抑炎型小胶质细胞的所有代谢基因转录组,发现LPS激活的小胶质细胞主要在糖酵解、三羧酸循环、花生四烯酸和磷酸肌醇等代谢通路上有明显的改变,而IL-4激活的小胶质细胞主要在花生四烯酸途径相关基因的发生改变。
由于对血脑屏障的保护,脑实质内的小胶质细胞很少暴露于病原体相关分子模式 (pathogen-associated molecular patterns, PAMPs),如LPS等。小胶质细胞经常被损伤相关分子模式 (damage-associated molecular pattern, DAMPs)激活。ATP作为最常见的DAMPs,已被证明在缺血、疼痛和癫痫等多种神经疾病中无菌激活小胶质细胞。因此,课题组进一步通过seahorse生物能量代谢分析技术手段,实时监控在LPS激活M1型和IL-4激活M2型,以及ATP无菌激活的小胶质细胞的代谢特性,发现LPS和ATP有效促进小胶质细胞的糖酵解过程,而LPS抑制氧化磷酸化,但ATP激活氧化磷酸化。此外,IL-4激活的小胶质细胞糖酵解和氧化磷酸化改变不明显(图1)。
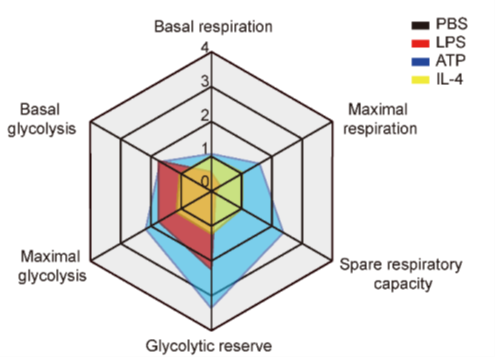 |
图1. 小胶质细胞响应LPS、ATP和IL-4激活,糖酵解以及氧化磷酸化代谢变化。
此外,课题组还发现,在LPS和ATP激活的小胶质细胞明显上调mTOR信号通路。通过抑制mTOR信号通路,可以有效抑制LPS和ATP诱导的糖酵解升高,以及ATP诱导的氧化磷酸化升高。并且LPS以及ATP激活的小胶质细胞的细胞因子合成的升高,依赖于mTOR信号通路和糖酵解代谢的激活与升高。
这项研究结果表明,LPS可以促进小胶质细胞的糖酵解,但抑制氧化磷酸化。ATP促进糖酵解和氧化磷酸化。mTOR信号通路可以有效调控LPS和ATP介导的不同的代谢重编程。并且,阻断mTOR或糖酵解代谢,有效降低细胞活化所引起的免疫效应,揭示CNS中小胶质细胞的代谢编程在免疫调控中的重要作用。这一发现或为靶向治疗神经炎症带来新的思路。
这项研究工作出自浙江大学医学院浙江大学脑科学与脑医学学院,第一作者是博士研究生胡亚玲,共同通讯作者是高志华教授和段树民院士。该研究主要受国家自然科学基金委和科技部重点研发项目等资助。
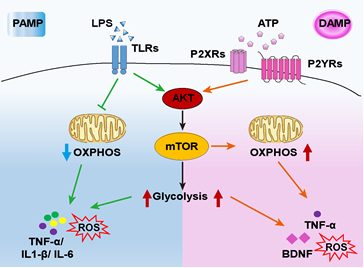 |
图2. 小胶质细胞响应PAMP (如LPS)或DAMP(如ATP)激活,通过mTOR信号通路调控代谢重编程和免疫反应。







